2. Vật liệu và phương pháp
2.1. Nguyên liệu thực vật
Lá cây Celastrus hindsii được thu thập từ xã Cao Dương, huyện Lương Sơn, tỉnh Hòa Bình, Việt Nam vào tháng 5 năm 2017. Mẫu vật đối chứng đã được sấy khô và khử trùng (số hiệu PPBC170506) được lưu giữ. Tất cả các mẫu đều được khử trùng, sấy khô trong lò ở 30°C trong một tuần, sau đó nghiền thành bột mịn.
2.2. Chuẩn bị dịch chiết
Một lượng bột 1,12 kg được ngâm trong methanol trong 30 ngày ở điều kiện môi trường xung quanh. Máy cô quay chân không (SB-350-EYELA, Tokyo, Nhật Bản) được sử dụng để loại bỏ dung môi ở nhiệt độ 50 °C. Sau đó, dịch chiết methanol thô được tách bằng hexane, ethyl acetate và dung dịch nước để thu được lần lượt 33,32 g, 133,33 g và 55,30 g dịch chiết. Dịch chiết EtOAc, dịch chiết hoạt tính mạnh nhất trong thử nghiệm sơ bộ, được phân tách bằng sắc ký cột sử dụng kỹ thuật gradient dung môi (chloroform và methanol) để thu được 14 phân đoạn. Các phân đoạn này sau đó được tiến hành phân tích TPC, TFC và hoạt tính chống oxy hóa. Quá trình phân tách dịch chiết EtOAc được mô tả trong
Hình 1. Phân tách dịch chiết EtOAc từ bột lá C. hindsii .
Bảng 1. Hiệu suất thu được của các phân đoạn tách bằng sắc ký cột từ các dung môi rửa giải khác nhau là cloroform và metanol.
2.3. Xác định tổng hàm lượng phenolic
Hàm lượng phenolic được đánh giá bằng phương pháp Folin-Ciocalteau [ 13 ] với một số sửa đổi nhỏ. Các mẫu thử được trộn với 0,125 mL thuốc thử Folin-Ciocalteu và sau đó lắc trong 6 phút. Tiếp theo, thêm 1,25 mL dung dịch Na2CO3 7% . Dung dịch hỗn hợp được điều chỉnh bằng methanol đến thể tích 3 mL, trộn đều và ủ ở nhiệt độ phòng trong điều kiện tối. Sau đó, ghi lại độ hấp thụ ở bước sóng 765 nm. Tổng hàm lượng phenolic được biểu thị bằng miligam tương đương axit gallic trên gam chiết xuất hoặc phân đoạn (mg GAE/g chiết xuất) theo đường cong chuẩn đã được chuẩn bị trước đó. Tất cả các mẫu được phân tích 3 lần.
2.4. Xác định hàm lượng flavonoid tổng cộng
Tổng hàm lượng flavonoid của C. hindsii được xác định bằng phương pháp đo màu clorua nhôm [ 14 ]. Trong thí nghiệm này, 100 µL clorua nhôm (III) hexahydrat (2% w / v trong nước) được thêm vào 100 µL mẫu chuẩn rutin. Sau khi ủ ở nhiệt độ phòng và điều kiện tối trong 15 phút, độ hấp thụ được đo ở 430 nm. Tổng hàm lượng flavonoid được tính toán theo đường cong chuẩn và được biểu thị bằng mg rutin tương đương trên g chiết xuất hoặc phân đoạn (mg RE/g chiết xuất).
2.5. Tính chất chống oxy hóa
2.5.1. Hoạt tính loại bỏ gốc tự do 2,2-Diphenyl-1-picrylhydrazyl (DPPH)
Hoạt tính chống oxy hóa của các chiết xuất và phân đoạn được phân lập được ước tính bằng phương pháp loại bỏ gốc tự do DPPH được mô tả bởi [ 15 ]. Cụ thể, một hỗn hợp chứa 0,5 mL mỗi mẫu, 0,25 mL DPPH 0,5 nM và 0,5 mL dung dịch đệm axetat 0,1 M (pH 5,5) được chuẩn bị và đặt trong bóng tối trong 30 phút ở điều kiện môi trường xung quanh. Độ hấp thụ của phản ứng được ghi lại ở bước sóng 517 nm bằng máy đọc vi phiến (Máy quang phổ vi phiến MultiskanTM, Thermo Fisher Scientific, Osaka, Nhật Bản). Methanol và BHT (10–50 ppm) được sử dụng làm đối chứng âm và dương tương ứng. Khả năng chống oxy hóa của các mẫu được thử nghiệm được tính toán bằng phương trình sau:
Trong đó S và C là độ hấp thụ tương ứng của phản ứng có và không có mẫu. Kết quả được biểu thị dưới dạng giá trị IC50 , xác định nồng độ mẫu cần thiết để loại bỏ 50% DPPH.
2.5.2. Axit 2,2′-Azinobis (3-Ethylbenzothiazoline-6-sulfonic) (ABTS)
Phương pháp ABTS được sử dụng để đánh giá đặc tính chống oxy hóa của C. hindsii [ 16 ]. Dung dịch ABTS được thu được bằng cách trộn 7 mM ABTS và 2,45 mM dung dịch kali persulfat. Sau khi ủ hỗn hợp trong bóng tối ở nhiệt độ phòng trong 16 giờ, MeOH được thêm vào để đạt được độ hấp thụ 0,70 ± 0,05 ở 734 nm. Một thể tích 24 µL của mỗi mẫu được trộn với 120 µL dung dịch ABTS, và hỗn hợp được ủ trong bóng tối ở điều kiện môi trường xung quanh trong 30 phút. Độ hấp thụ được đọc ở 734 nm bằng máy đọc vi phiến. BHT (5–125 µg/mL) được chọn làm chất chuẩn và MeOH là chất đối chứng âm. Hoạt tính loại bỏ gốc tự do ABTS được tính toán tương tự như phương pháp DPPH.
2.5.3. Thử nghiệm tẩy trắng β-Carotene
Phương pháp tẩy trắng β-carotene được sử dụng để đánh giá hoạt tính chống oxy hóa của C. hindsii [ 17 ]. Trước tiên, 2,0 mg β-carotene rắn và 10 mL cloroform được trộn đều. Sau đó, 1 mL dung dịch thu được được trộn với 20 µL axit linoleic và 200 mg Tween-40. Cloroform được loại bỏ bằng chân không ở 45 °C, sau đó thêm 50 mL nước oxy hóa để tạo nhũ tương. Tiếp theo, 0,12 mL mẫu được thêm vào 1 mL nhũ tương thu được trong ống nghiệm và hỗn hợp được ủ ở 50 °C. Độ hấp thụ được ghi lại ở 492 nm. Các phản ứng được đo cứ sau 15 phút trong 3 giờ. Methanol và BHT được sử dụng làm đối chứng âm và dương. Phần trăm ức chế peroxy hóa lipid (LPI) được xác định như sau:
trong đó A và B là các giá trị độ hấp thụ đo được tại thời điểm bắt đầu và kết thúc phản ứng, tương ứng.
2.6. Xác định các thành phần hóa học bằng phương pháp sắc ký khí khối phổ (GC-MS)
Các thành phần hóa học của các phân đoạn hoạt tính được xác định bằng cách sử dụng hệ thống GC-MS (JMS-T100 GVC, JEOL Ltd., Tokyo, Nhật Bản), theo các phương pháp trước đây [ 18 , 19 ]. Phân tích được thực hiện trên cột DB-5MS (30 m × 0,25 mm, độ dày 0,25 μm) sử dụng heli làm khí mang, với tỷ lệ chia tách là 5:1. Nhiệt độ đầu phun và đầu dò được duy trì ở mức lần lượt là 300 °C và 320 °C. Nhiệt độ lò được thiết lập như sau: 50 °C không giữ nhiệt, tăng 10 °C/phút đến 300 °C, giữ trong 20 phút. Các mẫu được pha loãng trong MeOH, và thể tích tiêm của mỗi mẫu là 1 µL. Phạm vi khối lượng được quét từ 29 amu đến 800 amu. Việc xác định các chất hóa học đã được thực hiện bằng cách sử dụng thư viện khối phổ của hệ thống GC-MS Mass Center phiên bản 2.65a của JEOL.
2.7. Phân tích khối phổ ion hóa phun điện (ESI-MS)
Các mẫu được phân tích bằng ESI-MS ở cả chế độ ion âm và ion dương. Nhiệt độ mao dẫn được đặt ở 140 °C (120 °C đối với S2) và điện áp phun là 3,0 KV (2,7 Kv đối với S2). Ở chế độ dương, các phân tích hợp chất được thực hiện ở điện áp phun ion là 3000 V và nhiệt độ mao dẫn là 350 °C. Các đỉnh được quét từ 280 đến 1000 m / z [ 20 ].
2.8. Phân tích thống kê
Phân tích thống kê được thực hiện bằng phương pháp ANOVA một chiều sử dụng phần mềm Minitab ® 16.2.3 ( © 2012 Minitab Inc.; Philadelphia, PA, USA). Kiểm định Turkey được sử dụng để xác định sự khác biệt có ý nghĩa thống kê ( p < 0,05) giữa các mẫu thử nghiệm. Kết quả được biểu thị dưới dạng giá trị trung bình ± sai số chuẩn.
3. Kết quả và thảo luận
3.1. Hoạt tính chống oxy hóa, tổng hàm lượng phenolic (TPC) và tổng hàm lượng flavonoid (TFC) của chiết xuất C. hindsii
trình bày hàm lượng chất chống oxy hóa, tổng hàm lượng phenolic và tổng hàm lượng flavonoid của các chiết xuất . Chiết xuất EtOAc thu được lượng TPC và TFC cao nhất (lần lượt là 371,19 và 124,011 mg GE/g chiết xuất). Kết quả cho thấy TPC, TFC và hoạt tính chống oxy hóa của các chiết xuất được thử nghiệm có sự khác nhau. Trong số các chiết xuất, EtOAc có TPC cao nhất (371,19 mg GAE/g chiết xuất) và TFC cao nhất (124,77 mg RE/g chiết xuất). Tương tự, hoạt tính chống oxy hóa của chiết xuất này cũng mạnh nhất (IC50 DPPH và ABTS lần lượt là 53,38 và 91,08 µg/mL) so với các chiết xuất khác, trong khi chiết xuất hexane không thể hiện bất kỳ hoạt tính chống oxy hóa nào. Do hoạt tính chống oxy hóa mạnh nhất, chiết xuất EtOAc sau đó được tách bằng sắc ký cột sử dụng kỹ thuật rửa giải gradient.
Bảng 2. Hoạt tính chống oxy hóa, tổng hàm lượng phenolic và tổng hàm lượng flavonoid trong chiết xuất C. hindsii
3.2. Tổng hàm lượng phenolic (TPC), tổng hàm lượng flavonoid (TFC) và hoạt tính chống oxy hóa của các phân đoạn được tách ra từ chiết xuất EtOAc
trình bày hàm lượng TPC, TFC và hoạt tính chống oxy hóa của mười bốn phân đoạn được tách ra từ dịch chiết EtOAc bằng phương pháp sắc ký cột. Nhìn chung, ngoại trừ P14, các phân đoạn từ P9–P13 cho thấy hàm lượng TPC và TFC cao hơn đáng kể so với các phân đoạn P1-P8. Trong số đó, hàm lượng TPC và TFC cao nhất được quan sát thấy ở các phân đoạn P12-P12, với độ pha loãng giữa cloroform và methanol dao động từ 50–70%. Khi tỷ lệ methanol nhỏ hơn 30% và lớn hơn 90%, cả TPC và TFC đều giảm. Khả năng chống oxy hóa của các phân đoạn tỷ lệ thuận với hàm lượng TPC và TFC.
Bảng 3. Tổng hàm lượng polyphenol (TPC), tổng hàm lượng flavonoid (TFC) và khả năng chống oxy hóa của các phân đoạn được tách ra từ dịch chiết EtOAc của lá C. hindsii .
Kết quả trong cũng cho thấy rằng sự pha loãng giữa cloroform và metanol ảnh hưởng mạnh mẽ đến khả năng chống oxy hóa của C. hindsii, được phản ánh qua cả hoạt tính loại bỏ gốc tự do ABTS và DPPH, thể hiện bằng giá trị IC50 . Trong số các mẫu này, giá trị IC50 thấp hơn cho thấy hoạt tính chống oxy hóa mạnh hơn. Các phân đoạn P1–P4, P6 và P8 không thể hiện bất kỳ hoạt tính chống oxy hóa nào, và khi pha loãng metanol là 5%, chỉ quan sát thấy khả năng chống oxy hóa không đáng kể. Tuy nhiên, khi pha loãng metanol tăng lên >10%, hoạt tính loại bỏ gốc tự do ABTS và DPPH tăng nhanh chóng. Khả năng ABTS và DPPH tối đa được tìm thấy ở các phân đoạn P12–P13, nơi tỷ lệ metanol tăng lên 50–70%. Tuy nhiên, khi pha loãng metanol vượt quá 70%, khả năng chống oxy hóa lại giảm ( ). So sánh với BHT tiêu chuẩn, các phân đoạn P12–P13 có tiềm năng cao nhất, có thể chứa các thành phần hoạt tính chống oxy hóa, trong đó mức độ chống oxy hóa của từng hợp chất cần được phân tích thêm. Kết quả thử nghiệm cho thấy việc pha loãng methanol ở nồng độ 50–70% kết hợp với chloroform mang lại tiềm năng chống oxy hóa tối đa trong cả hoạt động loại bỏ gốc tự do ABTS và DPPH của cây thuốc C. hindsii . Ngược lại, khi methanol chiếm 90% dung dịch, cả hoạt động loại bỏ gốc tự do DPPH và ABTS đều giảm nhanh chóng ( ). Khả năng chống oxy hóa của C. hindsii cũng được đo bằng phương pháp tẩy trắng β -carotene, như thể hiện trong Hoạt tính chống oxy hóa được biểu thị bằng giá trị %LPI so với quá trình oxy hóa β -carotene. Hầu hết các phân đoạn từ chiết xuất ethyl acetate đều có hoạt tính chống oxy hóa. Giá trị phần trăm LPI của các phân đoạn EtOAc dao động từ 57% đến 90% ( ). Quan sát cho thấy tất cả các chiết xuất được điều chế từ C. hindsii đều làm giảm quá trình oxy hóa β -carotene, mặc dù mức độ ức chế khác nhau giữa các phân đoạn. Trong số các phân đoạn được phân lập, quá trình oxy hóa axit linoleic bị ức chế hiệu quả bởi phân đoạn P12 (C:M = 1:1; LPI = 90%), tiếp theo là các phân đoạn P13 (98%) và P9 (87%). Các phân đoạn này thể hiện mức độ chống oxy hóa gần bằng với BHT tiêu chuẩn ( ). Kết quả này cho thấy C. hindsii sở hữu khả năng chống oxy hóa mạnh.
3.3. Mối tương quan giữa hàm lượng phenolic và hoạt tính chống oxy hóa
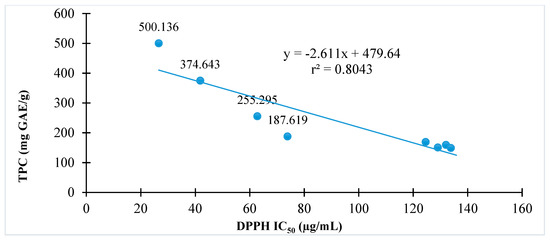
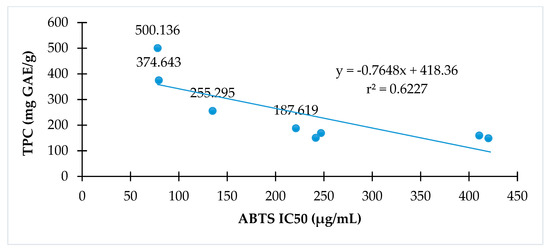
Mối quan hệ giữa hoạt tính chống oxy hóa được thể hiện bằng phương pháp DPPH hoặc ABTS với tổng hàm lượng phenolic của C. hindsii được trình bày trong và tương ứng. Kết quả cho thấy tổng hàm lượng phenolic tỷ lệ thuận với hoạt tính loại bỏ gốc tự do DPPH (r² = 0,80) hoặc hoạt tính loại bỏ gốc tự do ABTS (r² = 0,62). Các phân đoạn có tổng hàm lượng phenolic cao có khả năng chống oxy hóa cao trong cả hai phương pháp thử nghiệm DPPH và ABTS.
Hình 2. Mối quan hệ giữa hoạt tính chống oxy hóa và tổng hàm lượng phenolic của C. hindsii bằng phương pháp loại bỏ gốc tự do 1,1-diphenyl-2-picryhydrazyl (DPPH).
Hình 3. Mối quan hệ giữa hoạt tính chống oxy hóa và tổng hàm lượng phenolic của C. hindsii bằng phương pháp đo hoạt tính loại bỏ gốc tự do ABTS.
3.4. Xác định các hợp chất hoạt tính sinh học bằng GC-MS và ESI-MS
Các phân đoạn hoạt tính sinh học bao gồm P1, P4–P14 đã được phân tích bằng GC-MS và EIS-MS để xác định sự hiện diện của các hợp chất chính, bao gồm axit hexadecanoic, α-amyrin, β-amyrin, hydrazine carboxaminde, (3β)-D:C-friedours-7-en-3-ol, fucosterol, β-sitosterol, phytol, dihydroxylacetone, rutin, glycerin, 2′-hydroxyacetophenone và 2-hydroxy-1-ethyl ester ( ). Diện tích đỉnh (%) được sử dụng để so sánh nồng độ các hợp chất được phát hiện trong mỗi phân đoạn. Kết quả cho thấy sự hiện diện và nồng độ của các thành phần được xác định khác nhau giữa các phân đoạn P1 và P4–P14. Trong số các phân đoạn này, cả α-amyrin và β-amyrin đều cho thấy nồng độ tối đa ở P1 và P4 (25,56–57,67%). Lượng β-amyrin trong P5 và P7 lớn hơn lượng α-amyrin, tuy nhiên, α-amyrin chiếm 31,74% trong P8, trong khi không phát hiện thấy dấu vết của β-amyrin trong phân đoạn này. Tuy nhiên, cả α-amyrin và β-amyrin đều không được phát hiện trong các phân đoạn P9–P14 ( ). Ngoại trừ P1, hợp chất hydrazine carboxamide được tìm thấy trong tất cả các phân đoạn P4–14. Phân đoạn P4 cho thấy nồng độ cao nhất (38,64%), tiếp theo là P13 (21,43%), trong khi các phân đoạn khác cho thấy lượng thấp hơn (1,84–13,75%) ( ). Axit hexadecenoic chỉ được xác định trong P1, P10 và P11, trong đó P10 cho thấy lượng lớn nhất (13,09%). Các hợp chất chính khác bao gồm fucosterol (43,62%, P5), (3β)-D:C-friedours-7-en-3-ol (29,3%, P5), rutin (7,45%, 12,46% và 7,43% trong P9, P10 và P13 tương ứng), và este 2-hydroxy-1-ethyl (20,22%, P13) ( ). Các hóa chất được xác định khác chiếm tỷ lệ thấp hơn nhiều (<5%).
Bảng 4. Các hợp chất chính được xác định trong C. hindsii bằng GC-MS và ESI-MS.
5. Kết luận
Nghiên cứu này quan sát thấy rằng ethyl acetate là dung môi chiết xuất hiệu quả nhất để chiết xuất các chất chống oxy hóa tiềm năng từ C. hindsii . Việc sử dụng methanol ở nồng độ 50–70% kết hợp với chloroform mang lại hoạt tính loại bỏ gốc tự do DPPH và ABTS tối đa. Phân tích GC-MS và ESI-MS cho thấy sự hiện diện của mười lăm hợp chất, với các thành phần chính là α-amyrin, β-amyrin, hydrazine carboxamide, axit hexadecanoic, fucosterol, (3β)-D:C-friedours-7-en-3-ol, rutin và 2-hydroxy-1-ethyl ester. Để xác nhận và mở rộng các kết quả này, cần tiến hành nghiên cứu sâu hơn về các đặc tính dược liệu và dược phẩm của cây này, cũng như cần nghiên cứu chi tiết hơn về việc phân lập và tinh chế các hóa chất có hoạt tính sinh học từ cây này.